蛋白质结构
蛋白质复杂的分子结构分成4个层次,即一级、二级、三级、四级结构,后三者统称为高级结构或空间构象(conformation)。
但并非所有的蛋白质都有四级结构,由一条肽链形成的蛋白质只有一级、二级和三级结构,由2条或2条以上肽链形成的蛋白质才有四级结构。
一、一级结构
从 N-端至C-端的氨基酸排列顺序称为蛋白质一级结构(protein primary structure)。蛋白质一级结构中的主要化学键是肽键;此外,蛋白质分子中所有二硫键的位置也属于一级结构范畴。有链内二硫键,链间二硫键。
蛋白质一级结构并不是决定蛋白质空间构象的唯一因素。
二、二级结构
蛋白质二级结构(protein secondary structure)是指蛋白质分子中某一段肽链的局部空间结构,也就是该段肽链主链骨架原子的相对空间位置,并不涉及氨基酸残基侧链的构象。所谓肽链主链骨架原子即氨基氮原子、α-碳原子和羰基碳原子3个原子依次重复排列。
蛋白质二级结构主要包括α-螺旋、β-折叠、β-转角和Ω环。
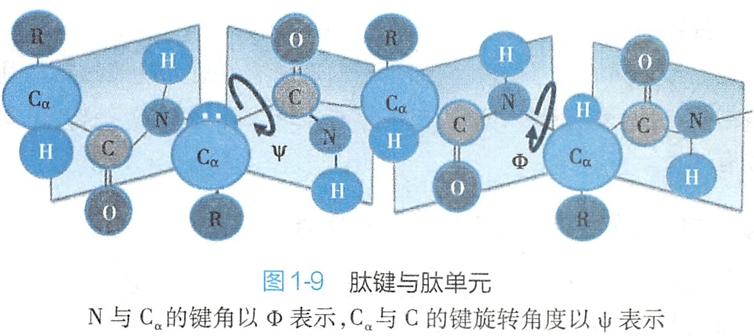
(一)肽单元
参与肽键的6个原子位于同一平面,Cα1和Cα2在平面上所处的位置为反式(trans)构型,此同一平面上的6个原子构成了所谓的肽单元(图1- 9)。其中肽键(C-N)的键长为介于C-N的单键长和双键长之间,所以有一定程度双键性能,不能自由旋转。
(二)α-螺旋
α-螺旋(a-helix)和β-折叠(β-pleated sheet),它们是蛋白质二级结构的主要形式。
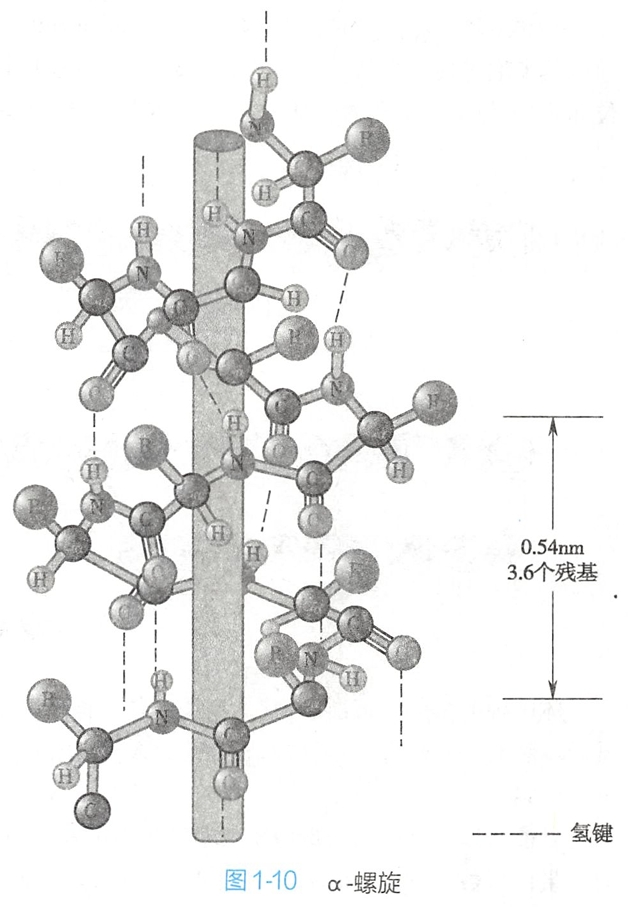
在α-螺旋结构(图1-10)中,多肽链的主链围绕中心轴作有规律的螺旋式上升,螺旋的走向为顺时针方向,即所谓右手螺旋,氨基酸侧链伸向螺旋外侧。每3.6个氨基酸残基螺旋上升一圈(即旋转360°),螺距为0.54nm。α-螺旋的每个肽键的N-H和第四个肽键的羰基氧形成氢键,氢键的方向与螺旋长轴基本平行。
一般而言,20种氨基酸均可参与组成α-螺旋结构,但是Ala、Glu、Leu和Met比Gly、Pro、Ser及Tyr更常见。
在蛋白质表面存在的α-螺旋,常具有两性特点,即由3至4个疏水氨基酸残基组成的肽段与由3~4个亲水氨基酸残基组成的肽段交替出现,致使α-螺旋的一侧为疏水性氨基酸,另一侧为亲水性氨基酸,使之能在极性或非极性环境中存在。这种两性α-螺旋可见于血浆脂蛋白、多肽激素和钙调蛋白激酶等。
肌红蛋白和血红蛋白分子中有许多肽链段落呈α-螺旋结构。毛发的角蛋白、肌组织的肌球蛋白以及血凝块中的纤维蛋白,它们的多肽链几乎全长都卷曲成α-螺旋。数条α-螺旋状的多肽链可缠绕起来,形成缆索,从而增强其机械强度,并具有可伸缩性(弹性)。
(三)β-折叠
β-折叠使多肽链形成片层结构 。β-折叠结构(图1-11)中,多肽链充分伸展,每个肽单元以Cα为旋转点,依次折叠成锯齿状结构,氨基酸残基侧链交替地位于锯齿状结构的上下方。
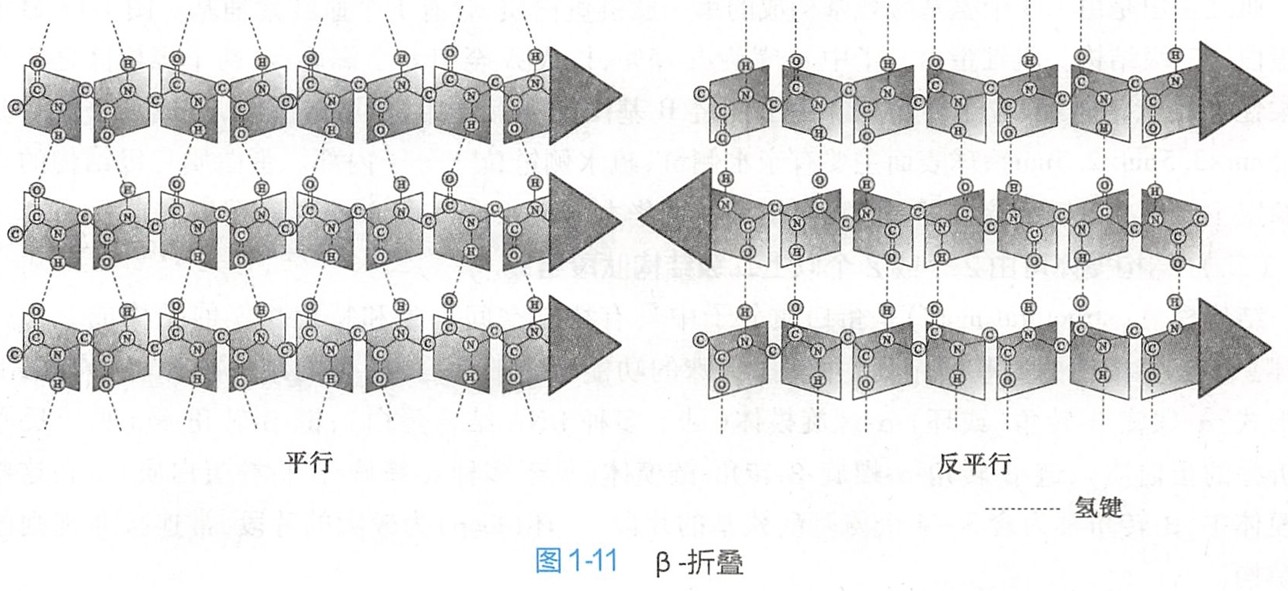
所形成的锯齿状结构一般比较短,只含5~8个氨基酸残基。一条肽链内的若干肽段的锯齿状结构可平行排列,分子内相距较远的两个肽段可通过折叠而形成相同走向,也可通过回折而形成相反走向。蚕丝蛋白几乎都是β-折叠结构,许多蛋白质既有α-螺旋又有β-折叠结构。
(四)β-转角和Ω-环
β-转角和Ω-环存在于球状蛋白质中。除α-螺旋和β-折叠外,蛋白质二级结构还包括β-转角(β-turm)(图1-12)和Ω环(Ω loop)。
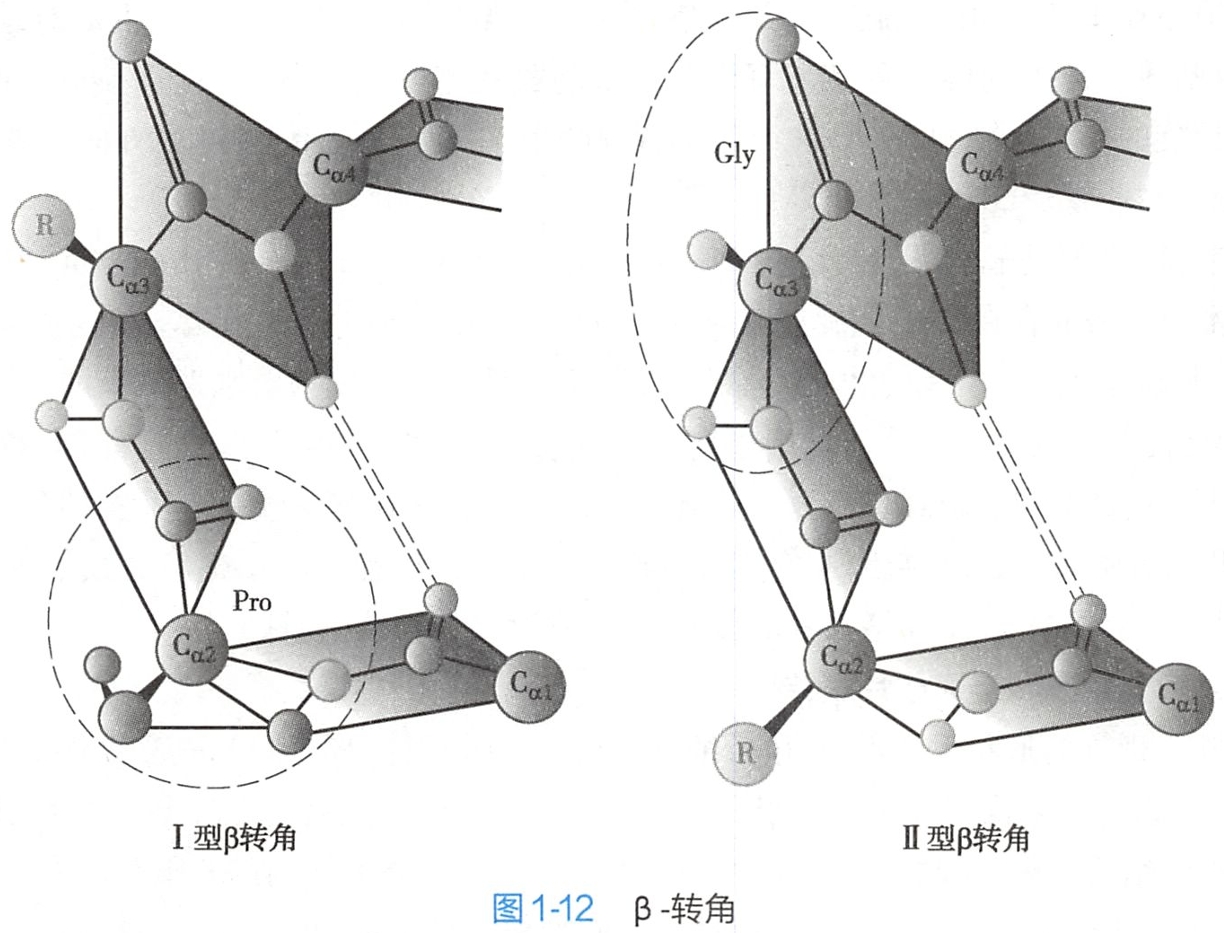
β-转角常发生于肽链进行180°回折时的转角上。β-转角通常由4个氨基酸残基组成,其第一个残基的羰基氧(O)与第四个残基的氨基氢(H)可形成氢键。β-转角的结构较特殊,第二个残基常为脯氨酸,其他常见残基有甘氨酸、天冬氨酸、天冬酰胺和色氨酸。有2种类型的β-转角,分别是转角I和转角Ⅱ。 I型β转角和Ⅱ型B转角非常相似,只是其中肽键的二面角有所不同。Ⅱ型B转角的第3个残基往往是甘氨酸。
Ω环是存在于球状蛋白质中的一种二级结构。这类肽段形状象希腊字母Ω,所以称Ω环。Ω环这种结构总是出现在蛋白质分子的表面,而且以亲水残基为主,在分子识别中可能起重要作用。
(五)氨基酸残基的侧链影响二级结构的形成
蛋白质二级结构是以一级结构为基础的。一段肽链会出现其氨基酸残基的侧链适合形成的二级结构。
例如一段肽链有多个谷氨酸或天冬氨酸残基相邻,则在pH7.0时这些残基的游离羧基都带负电荷,彼此相斥,妨碍α-螺旋的形成。同样,多个碱性氨基酸残基在一肽段内,由于正电荷相斥,也妨碍α-螺旋的形成。
此外天冬酰胺、亮氨酸的侧链很大,也会影响α-螺旋形成。
脯氨酸的N原子在刚性的五元环中,其形成的肽键N原子上没有H,所以不能形成氢键,结果肽链走向转折,不形成α-螺旋。
形成β-折叠的肽段,氨基酸残基的侧链要比较小,能容许两条肽段彼此靠近。
三、三级结构
(一)三级结构
蛋白质三级结构(protein tertiary structure)是指整条肽链中全部氨基酸残基的相对空间位置,也就是整条肽链所有原子在三维空间的排布位置。
已知球状蛋白质的三级结构有某些共同特征,如折叠成紧密的球状或椭球状;含有多种二级结构并具有明显的折叠层次,即一级结构上相邻的二级结构常在三级结构中彼此靠近并形成超二级结构,进一步折叠成相对独立的三维空间结构;以及疏水侧链常分布在分子内部等。
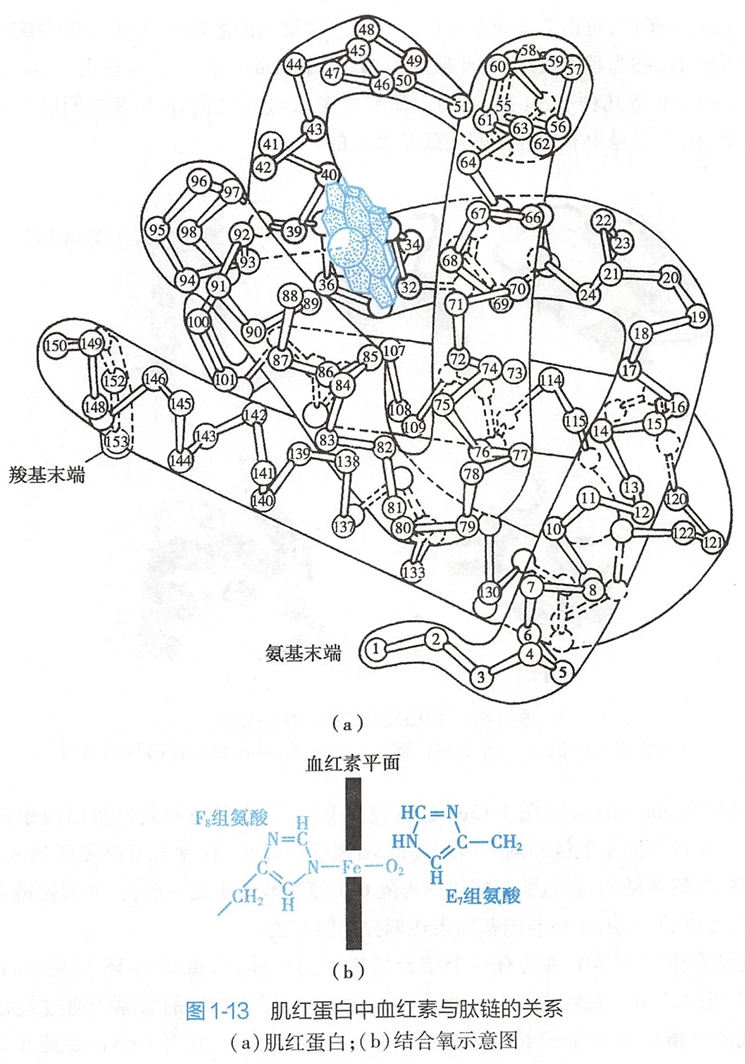
肌红蛋白是由153个氨基酸残基构成的单一肽链蛋白质,含有1个血红素辅基。图1-13显示肌红蛋白的三级结构。肌红蛋白分子中α-螺旋占75%,构成A至H共8个螺旋区,两个螺旋区之间有一段柔性连接肽,脯氨酸位于转角处。由于侧链R基团的相互作用,多肽链缠绕,形成一个球状分子,球表面主要有亲水侧链,疏水侧链位于分子内部。
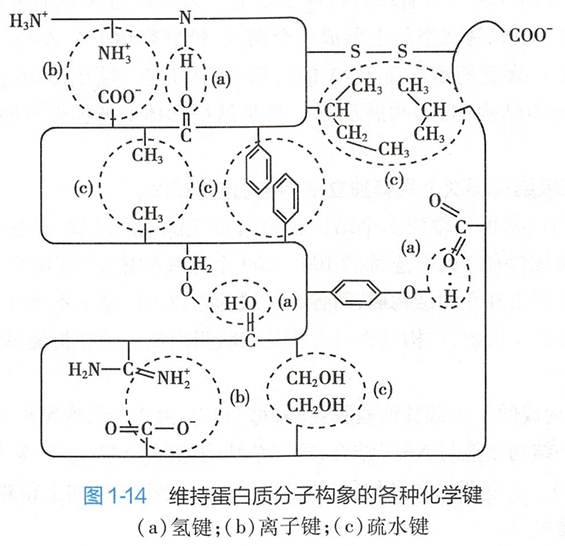
蛋白质三级结构的形成和稳定主要靠次级键如疏水键、盐键、氢键和范德华力(van der Waals force)等(图1-14)。(盐键应该是化学键的一种,不过这里的盐键是分子间)
(二)结构模体
结构模体(structural motif)是蛋白质分子中具有特定空间构象和特定功能的结构成分。结构模体可由2个或2个以上二级结构肽段组成。一个模体总有其特征性的氨基酸序列,并发挥特殊的功能。
一般而言,常见的结构模体可以有以下几种形式:α-螺旋-β-转角(或环)-α-螺旋模体(见于多种DNA结合蛋白);链-β-转角-链(见于反平行 B-折叠的蛋白质);链-β-转角-α-螺旋-β-转角-链模体(见于多种α-螺旋/β-折叠蛋白质)。在这些结构模体中,β-转角常为含3~4个氨基酸残基的片段;而环(loop)为较大的片段,常连接非规则的二级结构。
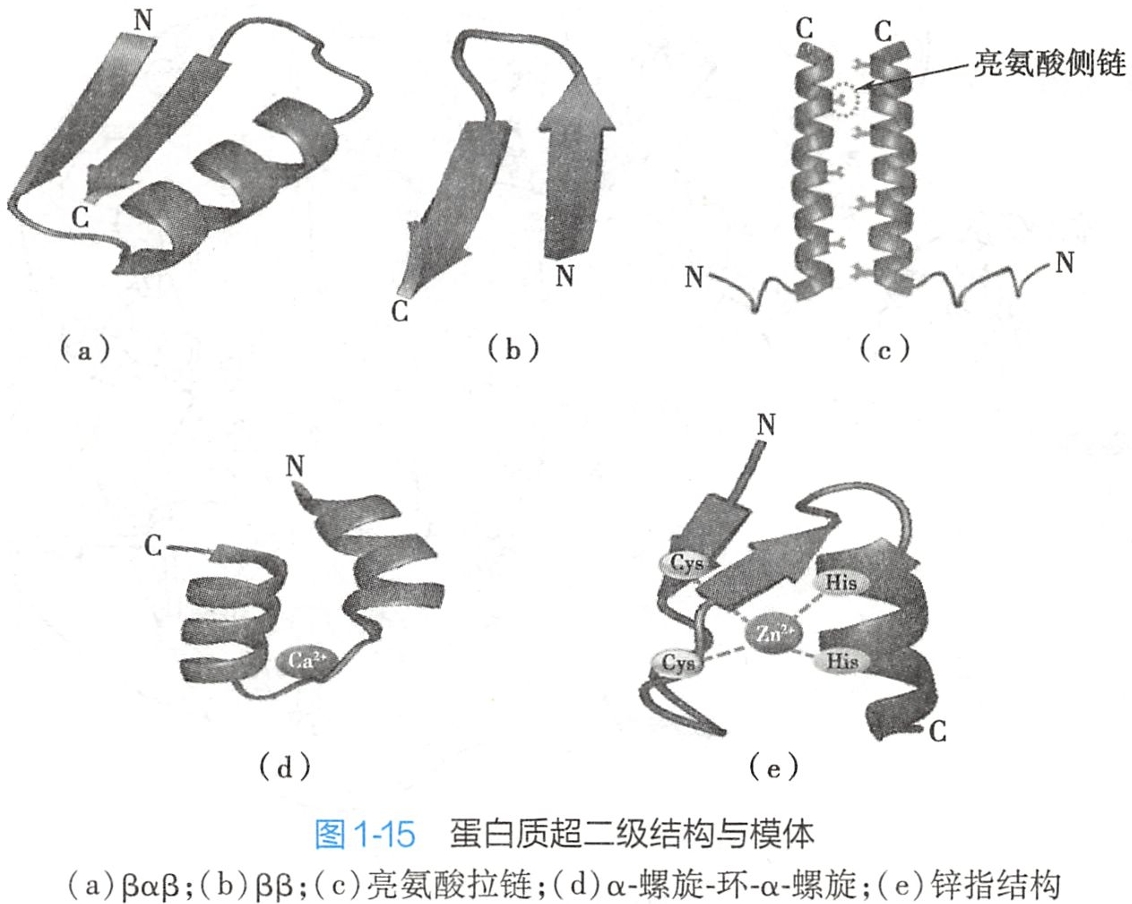
在许多蛋白质分子中,可由2个或2个以上具有二级结构的肽段在空间上相互接近,形成一个有规则的二级结构组合,称为超二级结构。目前已知的二级结构组合有αα、βαβ、ββ等几种形式(图1-15)。
亮氨酸拉链(leucine zipper)(图1-15c)是出现在DNA结合蛋白和其他蛋白质中的一种结构模体。当来自同一个或不同多肽链的两个两用性的α-螺旋的疏水面(常含有亮氨酸残基)相互作用形成一个圈对圈的二聚体结构,亮氨酸有规律地每隔6个氨基酸就出现一次,亮氨酸拉链常出现在真核生物DNA结合蛋白的C-端,往往与癌基因表达调控功能有关。
在许多钙结合蛋白分子中通常有一个结合钙离子的模体,它由螺旋-环-螺旋(helix--loop-helix)三个肽段组成(图1-15d),在环中有几个恒定的亲水侧链,侧链末端的氧原子通过氢键而结合钙离子。
近年发现的锌指(zinc finger)结构也是一个常见的模体例子,它由1个α-螺旋和2个反平行的β-折叠三个肽段组成(图1-15e),具有结合锌离子功能。该模体的N-端有1对半胱氨酸残基,C-端有1对组氨酸残基,此4个残基在空间上形成一个洞穴,恰好容纳1个Zn2+。由于Zn2+可稳固模体中的α-螺旋结构,使此α-螺旋能镶嵌于DNA的大沟中,因此含锌指结构的蛋白质都能与DNA或RNA结合。
(三)结构域
是三级结构层次上具有独立结构与功能的区域。分子量较大的蛋白质常可折叠成多个结构较为紧密且稳定的区域,并各行其功能,称为结构域(domain)。
大多数结构域含有序列上连续的100~200个氨基酸残基,若用限制性蛋白酶水解,含多个结构域的蛋白质常分解出独立的结构域,而各结构域的构象可以基本不改变,并保持其功能。超二级结构则不具备这种特点。
因此,结构域也可看作是球状蛋白质的独立折叠单位,有较为独立的三维空间结构。
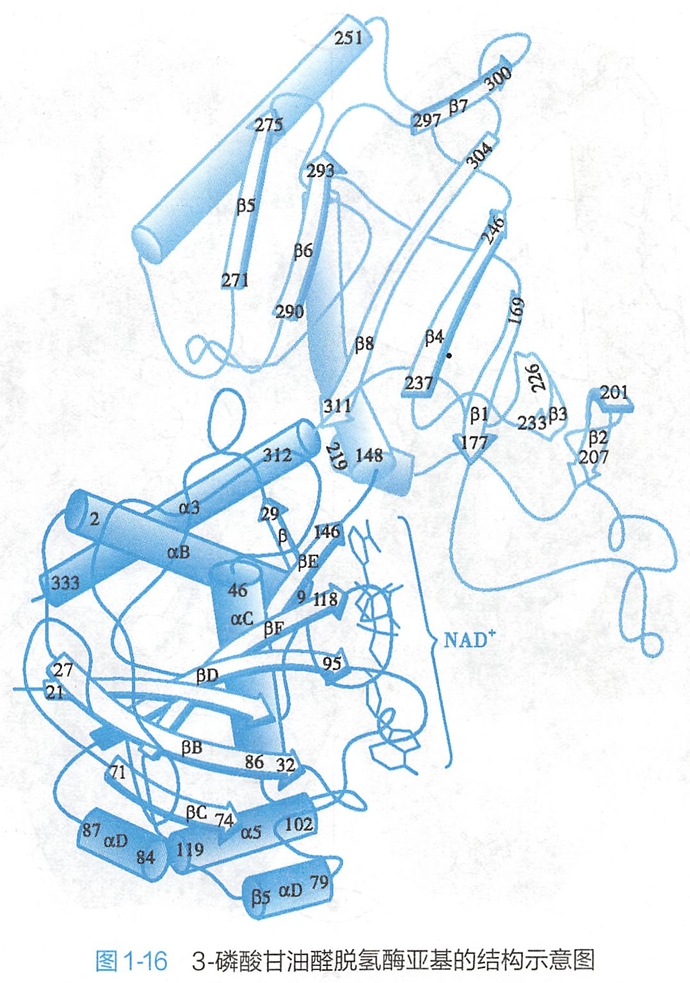
例如,由2个亚基构成的3-磷酸甘油醛脱氢酶,每个亚基由2个结构域组成,N-端第1~146个氨基酸残基形成的第一个结构域能与NAD+结合,第二个结构域(第147~333氨基酸残基)与底物3-磷酸甘油醛结合(图1-16)。
有些蛋白质各结构域之间接触较紧密,从结构上很难划分,因此,并非所有蛋白质的结构域都明显可分。
(四)多肽链折叠
蛋白质合成后,在一定的条件下,可能只形成一种正确的空间构象。除一级结构为决定因素外,还需要在一类称为分子伴侣(molecular chaperone)的蛋白质辅助下,合成中的蛋白质才能折叠成正确的空间构象(见第十五章)。只有形成正确的空间构象的蛋白质才具有生物学功能。
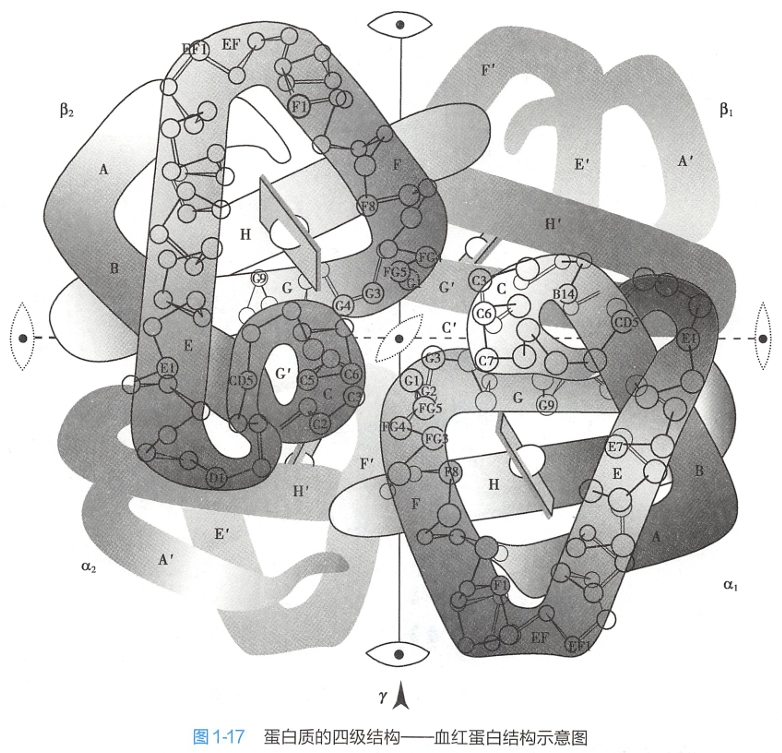
四、四级结构
体内许多功能性蛋白质含有两条或两条以上多肽链。每一条多肽链都有其完整的三级结构,称为亚基(subunit),亚基与亚基之间呈特定的三维空间排布,并以非共价键相连接。蛋白质分子中各个亚基的空间排布及亚基接触部位的布局和相互作用,称为蛋白质四级结构(protein quaternary structure)。
在四级结构中,各亚基间的结合力主要是氢键和离子键。
在2个亚基组成的四级结构蛋白质中,若亚基结构相同,称之为同二聚体(homodimer),若亚基分子不同,则称之为异二聚体(heterodimer),多个亚基可以此类推。对于2个以上亚基构成的蛋白质,单一亚基一般没有生物学功能,完整的四级结构是其发挥生物学功能的保证。
成人血红蛋白的α亚基和β亚基分别含有141个和146个氨基酸。两种亚基的三级结构颇为相似,且每个亚基都可结合1个血红素(heme)辅基(图1-17)。4个亚基通过8个离子键相连,形成血红蛋白四聚体,具有运输O2和CO2的功能。但每一个亚基单独存在时,虽可结合氧且与氧亲和力增强,但在体内组织中难于释放氧,失去了血红蛋白原有的运输氧的作用。
五、蛋白质分类
(一)组成
除氨基酸外,某些蛋白质还含有其他非氨基酸组分。因此根据蛋白质组成成分可分成单纯蛋白质和结合蛋白质,前者只含氨基酸,而后者除蛋白质部分外,还含有非蛋白质部分,为蛋白质的生物学活性或代谢所依赖。
结合蛋白质中的非蛋白质部分被称为辅基,绝大部分辅基是通过共价键方式与蛋白质部分相连。构成蛋白质辅基的种类也很广,常见的有色素化合物、寡糖、脂质、磷酸、金属离子甚至分子量较大的核酸。细胞色素c(cytochrome c,Cytc)是含有色素的结合蛋白质,其铁卟啉环上的乙烯基侧链与蛋白质部分的半胱氨酸残基以硫醚键相连,铁卟啉中的铁离子是细胞色素c的重要功能位点。
免疫球蛋白是一类糖蛋白,作为辅基的数支寡糖链通过共价键与蛋白质部分连接。
(二)形状
蛋白质还可根据其形状分为纤维状蛋白质和球状蛋白质两大类。一般来说,纤维状蛋白质形似纤维,其分子长轴的长度比短轴长10倍以上。纤维状蛋白质多数为结构蛋白质,较难溶于水,作为细胞坚实的支架或连接各细胞、组织和器官的细胞外成分,如胶原蛋白、弹性蛋白、角蛋白等。大量存在于结缔组织中的胶原蛋白就是典型的纤维状蛋白质,其长轴为300nm,而短轴仅为1.5nm。
球状蛋白质的形状近似于球形或椭球形,多数可溶于水,许多具有生理学功能的蛋白质如酶、转运蛋白、蛋白质类激素、代谢调节蛋白、基因表达调节蛋白及免疫球蛋白等都属于球状蛋白质。
(三)结构和功能
随着蛋白质结构与功能研究的不断深入,发现体内氨基酸序列相似而且空间结构与功能也十分相近的蛋白质有若干,即产生了“蛋白质家族(protein family)”这一概念。属于同一蛋白质家族的成员,称为同源蛋白质(homologous protein)。人们通过对蛋白质家族成员的比较,可得到许多物种进化的重要证据。
在体内还发现,2个或2个以上的蛋白质家族之间,其氨基酸序列的相似性并不高,但含有发挥相似作用的同一模体结构,通常将这些蛋白质家族归类为超家族(superfamily)。这些超家族成员是由共同祖先进化而来的一大类蛋白质。